Her gennemgås noget af den metabolske og hormonelle regulering vi ser i kroppen, dvs. hvad sker der hvis vi faster og hvad sker der hvis vi spiser noget.
Lipolysen – nedbrydning af fedt
Lipolyse er nedbrydning af triacylglycerider (TAG) til frie fedtsyrer (FA) og glycerol. I fedtvævet (adipøse væv) sker denne proces konstant, men den reguleres af forskellige hormoner. Nedbrydningen sker ved at triacylglycerider (TAG) først omdannes til diacylglycerider (DAG) der omdannes til monoacylglycerider (MAG) og herefter til frie fedtsyrer (FA).
TAG -> DAG -> MAG -> FA
Det er tre forskellige lipaser der katalyserer disse reaktioner. Enzymet ATGL (Adipose triglyceride lipase) katalyserer TAG -> DAG, HSL (hormon sensitiv lipase) katalyserer DAG -> MAG og MAG lipase katalyserer MAG -> FA. Når lipaserne er aktiverede ved phosphorylering vil de katalysere disse reaktioner.
Proteinet Pirilipin vil når det er phosphoryleret lette adgangen for lipaser til TAG. En aktivering af dette protein vil altså også fremme lipolyse.
Glukagon og adrenalin kan binde til GPCR (G-proteinkoblede receptorer) på overfladen af adipocytten (fedtcellen) og aktivere protein kinase A, som phosphorylerer lipaser og pirilipin. Glukagon frigives når glucose niveauet bliver lavt, f.eks. ved faste. Dette betyder at faste stimulerer lipolysen.
Re-esterificering – opbygning af fedt
Omvendt sker der også løbende en omdannelse af FA til TAG. Ved faste vil der være mindre glucose til stede og dermed også glycerol-3-phosphat, hvilken gør at re-esterificeringen af FA til TAG er sænket.
Det er dog ikke helt så enkelt da enzymet PEPCK-c (cytosolisk phosphoenolpyruvat carboxykinase) aktiveres under faste. Dette enzym katalyserer omdannelsen af ikke-carbohydrate precursere til glycerol-3-phosphat, hvilket medfører at mere FA re-esterificeres til TAG. Man kalder dette for FA-recycling og det er en beskyttende mekanisme kroppen har mod lipotoksiske effekter, f.eks. under faste eller diabetes. Dette forhindrer altså en for kraftig FA mobilisering.
Der frigives glycerol og tre FA ved lipolysen. Glycerol sendes via blodet til leveren, hvor det enten nedbrydes til pyruvat eller opbygges til glukose via DHAP eller fosforyleres til glycerol-3-P, der kan bruges til at danne TAG eller fosfolipider.
For 75% af FA’s vedkommende re-esterificeres de til TAG igen. Dette kan enten ske med det samme i det adipøse væv inden FA frigives til blodet eller i leveren.
Andre indgår i en systemisk cyklus (TAG cyklus), hvor de sendes til leveren via blodet i serum albumin, hvor de reesterificeres til TAG, der fra leveren sendes til det adipøse væv igen som TAG i VLDL. Her frigives de igen som FA under katalyse af den ekstracellulære lipoprotein lipase. Flux igennem denne cyklus er lav, når der er andre former for energikilder tilgængelige i blodet.
Dette kan umiddelbart virke som spild af energi i en futil cyklus, men den forholdsvise store mængde af frie FA i blodet under faste repræsenterer en hurtigt mobiliseret energikilde i en ”fight or flight”- situation. Yderligere sikrer den dynamiske reesterficering af FA til TAG at der ikke opstår lipotoksitet i fedtvævet i forbindelse med kraftig hydrolysering af TAG under fx faste, altså har cellen en stor kapacitet til at fjerne FFA hurtigt fra cytoplasma hvis de ikke eksporteres (FA-recycling).
Som bekendt har adipocytter ikke glycerol kinase og kører ikke gluconeogenese, derfor kan cellerne ikke genere glycerol-3-phosphate til reesterficering. Dette problem har man fundet ud af cellerne omgår ved at udtrykke PEPCK som kan omdanne OAA til PEP som så kan omdannes til DHAP. Denne proces kan stimuleres af thiazolidinedioner (TZDs så som Rosiglitazone), som bruges i behandling af type II diabetes. Herved sænkes FA mobilisering hvorved blodbåren FA koncentration sænkes, dette modvirker ektopisk fedt akkumulering i fx muskler som normalt fører til insulin resistens.
Transport i blodet af glycerol og fedtsyrer
Frie fedtsyrer transporteres i blodet proteinbundet til albumin (sammen med bl.a. fedtopløselige vitaminer). Glycerol er vandopløselig og kan transportere frit i blodet.
Forbrænding af glycerol
Glycerol vil i leveren kunne indgå i glykolysen. Dette sker ved at glycerol phosphoryleres afglycerol kinasen, der kun udtrykkes i leveren, til glycerol-3-phosphat. Dette omdannes af G3P DH til DHAP, der indgår i glykolysen.
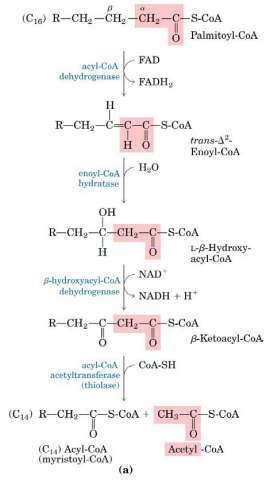
Betaoxidation – forbrænding af frie fedtsyrer
FA vil blive optaget i forskellige væv, f.eks. muskler, og blive oxideret der. Musklernes primære energikilde ved aerobe forhold er FA.
FA kan dog ikke forbrændes i alle celler. I nogle celler skyldes det at de ikke har mitekondrier. I hjernen kan FA heller ikke anvendes som energikilde, da FA ikke kan passere blodhjernebarrieren.
Når FA er blevet optaget i cellen skal den først aktiveres. Dette sker i cytosolen, ved at få påsat en CoA af acyl-CoA-synthetase. Dette koster 2 ATP, idet 2 ATP -> AMP.
acyl -> acyl-CoA (acyl-CoA synthetase)
Denne acyl-CoA skal nu transporteres ind i mitekondriet, da det er der oxidationen foregår. Denne transport sker ved carnitin. I den ydre mitekondrielle membran udskiftes CoA med carnitin ved enzymet CAT I (carnitin acyl tranferase I). Det er kun FA over 12C (langkædede fedtsyrer) der har behov for carnitin.
acyl-CoA -> acyl-carnitin (CAT I)
CAT I hæmmes af malonyl-CoA der dannes ved stimulering med insulin, som jo især er højt lige efter man har spist, dvs. ved højt energiniveau. På den måde bliver betaoxidationen altså hæmmet ved højt energiniveau.
Acyl-carnitin transporteres så over den indre mitekondrielle membran, ved en transporter der hedder CAT II (Carnitin acyl transferase II). Under denne proces udskiftes carnitin igen med CoA, så resultatet inde i mitekondriet er acyl-CoA igen. Den frigivne carnitin transporteres tilbage til cytosolen ved de samme transportere, da disse er antiportere.
acyl-carnitin -> acyl-CoA (CAT II)
Betaoxidationen foregår så i mitekondriet i 4 trin, der gentages flere gange, idet der fraspaltes 2C hver gang: oxidation/dehydrogenering, hydrering, oxidation/dehydrogenering og thiolyse/fraspaltning. For hver runde får man 1 AcetylCoA, 1 FADH2 og 1 NADH.
AcetylCoA kan så indgå i citronsyrecyklus, hvilket giver 3 NADH, 1 FADH2 og 1 GTP (ATP).
Hvis der er tale om en monoumættet FA, sparer acylCoA DH at skulle indføre en dobbeltbinding og derfor springes dette trin over – dvs. der dannes 1 FADH2 mindre. For mono-umættet FA (cis-position) behøves en isomerase til at konvertere dobbeltbindingen til en trans-position idetenoylCoA hydratase kun kan hydrere dobbeltbindinger i trans konfiguration.
For poly-umættede FA behøves både en isomerase og en reductase, der forbruger NADPH.
For FA med et ulige antal C foregår betaoxidation nøjagtig ligesom ved et lige antal C, bortset fra i sidste trin hvor der dannes propionylCoA i stedet for AcetylCoA. For videre nedbrydning carboxyleres propionyl CoA først til D-methylmalonyl CoA af propionyl CoA carboxylasen. Dette sker under forbrug af 1 ATP. D-methylmalonyl CoA omdannes herefter til sin stereoisomer L-methylmalonyl CoA af methylmalonyl CoA epimerasen. Ved intramolekylær re-arrangering omdannes L-methylmalonyl CoA til succinyl CoA af metylmalonyl CoA mutasen, der kræver coenzym B12. Succinyl CoA kan herefter indgå i citronsyrecyklus, idet udbyttet er 2 NADH mindre (kun 1 NADH, 1 FADH2 og 1 GTP).
Udbytte ved mættet fedtsyre med lige antal C
Bemærk i øvrigt at ved betaoxidation af et lige antal C i en fedtsyre, vil der være 1 NADH og 1 FADH2 pr. deling, men 1 AcetylCoA pr. 2C. Det betyder at resultatet er at der er 1 mere AetylCoA end NADH og FADH2.
NADH og FADH2 kan deltage i elektrontransportkæden, hvor NADH vil give 2,5 ATP og FADH2 vil give 1,5 ATP.
Det betyder at hvis vi forbrænder fedtsyren palmatinsyre der er en 16 C fedtsyre, får man altså følgende udbytte:
- Betaoxidation giver 8 AcetylCoA + 7 NADH + 7 FADH2
- Citronsyrecyklus giver 24 NADH + 8 FADH2 + 8 GTP (ATP)
- Elektrontransportkæden giver 77,5 ATP (24+7 NADH x 2,5 ATP/NADH) + 22,5 ATP (8+7 FADH2 x 1,5 ATP/NADH) + 8 ATP (8 GTP), dvs. 108 ATP.
- Aktivering af fedtsyren krævede 2 ATP
- Totalt udbytte er 106 ATP.
Korrektion ved monoumættet fedtsyre
Ved en monoumættet fedtsyre dannes der 1 FADH2 mindre, hvilket svarer til 1,5 ATP. Det endelige antal giver derfor ved en 16C monoumættet FA:
- Betaoxidation giver 8 AcetylCoA + 7 NADH + 6 FADH2
- Citronsyrecyklus giver 24 NADH + 8 FADH2 + 8 GTP (ATP)
- Elektrontransportkæden giver 77,5 ATP (24+7 NADH x 2,5 ATP/NADH) + 22,5 ATP (8+6 FADH2 x 1,5 ATP/NADH) + 8 ATP (8 GTP), dvs. 106,5 ATP.
- Aktivering af fedtsyren krævede 2 ATP
- Totalt udbytte er 104,5 ATP.
Korrektion ved mættet fedtsyre med ulige antal C
Hvis der er et ulige antal C, som f.eks. ved forbrænding af en 17C fedtsyre, vil det give 1 NADH, 1 FADH2 og 1 ATP mindre. Dette giver samlet 5 ATP mindre.
Zellweger syndrom
Personer, der lider af denne sygdom er ikke i stand til at danne funktionelle peroxisomer, hvilket resulterer i akkumulering af langkædet FA i blodet. Peroxisomer er organeller, der er i stand til at udføre beta-oxidation parallelt med mitochondrier, dog primært af meget langkædet fedtsyrer, mens mitochondriet oxiderer de kortere fedtsyrer. Det første step i beta-oxidationen adskiller sig fra den, der foregår i mitochondrierne ved at en flavoprotein acyl-CoA oxidase og ikke acyl CoA DH indfører den første dobbeltbinding og overfører elektronerne via FAD til oxygen, og danner derved H2O2. Dette er en giftig komponent i cellen og nedbrydes derfor af en catalase. I mitochondriet overføres elektronerne direkte fra FADH2 til ubiquinon i den indre mitochondrelle membran og indgår derved i elektrontransport kæden. I peroxixomer foregår mest oxidering af meget langkædet fedtsyrer samt forgrenede fedtsyrer. Zellwegers syndrom er en autosomal recessive gen-defekt hvilket betyder at mutationen skal være til stede på begge alleler. Sygdommen opstår som mutationer i ét eller flere af PEX generne (peroxisomal biogenesis factors) hvorved der er nedsat eller fraværende dannelse af peroxisomer som kan føre til misdannelser i nervesystemet gennem hypomyelination.
Ketonstoffer – dannelse og nedbrydning
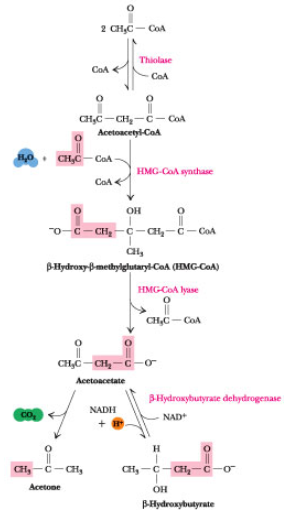
Ketonstoffer (KB) er en opløselig form for acetyl CoA. I en sult situation skal der spares på glukosen, og leveren vil derfor oxidere FA som energikilde. Ved denne oxidation dannes der acetyl CoA og et højt niveau af dette vil starte syntesen af KB. Akkumulering af acetyl CoA i en sult situation vil samtidig øges grundet mangel på oxaloacetat i TCA til at modtage acetyl CoA i denne cyklus, da OAA forbruges i glukoneogenesen, der stimuleres af glukagon. Dette sker primært efter et døgns faste, da leverens glykogenlager da er opbrugt og opretholdelsen da udelukkende afhænger af glukoneogenesen, hvilket vil nedsætte OAA markant.
KB frigives i blodet og optages af bl.a. hjernen, der under sult hurtig tilpasser sig forbrug af KB frem for glukose for at kunne spare på sidstnævnte.
De tre KB er som følger: Acetone, acetoacetat og D-β-hydroxybutyrat, hvoraf acetone hurtigt fordamper som gas.
De dannes som sagt i leveren og nedbrydes i det extrahepatiske væv (stort set alt andet end leveren), da leveren mangler thiophorasen (β-ketoacyl-CoA transferase), der er med til at nedbryde KB.
Syntesen sker i mitochondriet i leveren, hvor acetyl CoA akkumuleres. Bemærk at L-β-hydroxy acyl CoA DH fra beta-oxidationen ikke er den sammen som D-β-hydroxybutyrate CoA DH som cellen bruger i KB syntese idet enzymerne er meget stereoisomer specifikke.
Ved ubehandlet diabetes er der masser af glukose i blodet, men kroppen kan ikke registrere dette (pga. manglende insulin eller pga. dårlig registrering af insulin). Derfor vil hele kroppen være indstillet på en sultsituation, selvom dette ikke er tilfældet.ACC aktiveres af insulin, men dette vil jo ikke ske i denne situation og derfor vil [malonyl CoA] falde. Dette vil medføre, at hæmningen af carnitin acyl transferasen stopper og der vil ske en forøgelse af β-oxidationen. En stor mængde acetyl CoA vil derfor hobe sig i mitochondriet, da disse ikke kan gå igennem TCA og blive oxideret fordi substraterne i TCA er blevet brugt til glukoneogenesen. Dette vil accelerere dannelsen af KB og føre til ketoacidose og acidose, hvilket kan være livstruende.
En anden faktor er, at højt niveau af fedtsyrer i blodet vil fremme insulin udskillelsen. Insulin vil derfor være til stede i lave koncentrationer, men altså ikke helt forsvinde, under fasten. Insulin hæmmer glukoneogenesen og derved forbruget af OAA samt hæmme HSL og dermed frigivelsen af fedtsyrer fra adipocytterne, hvilket vil nedsætte disses frigivelse.
Fedtsyresyntese
Syntesen af fedtsyrer er i princippet det modsatte af betaoxidationen (nedbrydningen af fedtsyrer). Selve syntesen foregår dog i cytosolen, hvor en stor del af betaoxidationen foregik i mitekondriet. Syntesen består af følgende fire trin:
1) Kondensering mellem malonyl og acetyl, der begge sidder i thioester-binding i enzymet og derfor ikke længere indeholder CoA. Under denne kondensering frigives CO2.
2) Den dannede acetoacetyl-ACP bliver nu reduceret af NADPH katalyseret af beta-ketoacyl-ACP reduktasen og vi får D-beta-hydroxybutyryl.
3) Der sker en dehydrering katalyseret af beta-hydroxyacyl-ACP dehydratasen og vi får trans-Δ2-butyryl-ACP.
4) Til sidst sker der endnu en reducering katalyseret af enoyl-ACP reduktasen og vi får butyryl-ACP under forbrug af NADPH.
ACP er betegnelsen for den del af synthasen, hvortil den voksende kæde er forbundet. Disse fire steps gentages til kæden når 16 carbon atomer hvorefter den thiolyseres af som palmitoyl CoA.
Grunden til at netop palmitat frigives er, at thioesterasen har højere affinitet for denne fedtsyre. Derudover er interaktionen mellem den stadigt mere hydrophobe fedtsyre kæde og den tunnel i enzymkomplekset hvorudfra denne gror også af betydning. I særlige væv i nogle pattedyr er produktionen af mellem-lange fedtsyrer vigtig og der er her særlige mekanismer, der kan sikre denne produktion.
I pattedyr er alle ovennævnte enzymer del af samme enzymkompleks, hvilket har forskellige fordele: Udtrykket af de forskellige enzymer er sikret at være ensartet for de er del af samme polypeptidkæde, syntesen er hurtigere og mere effektiv og færre mellemprodukter går tabt undervejs.
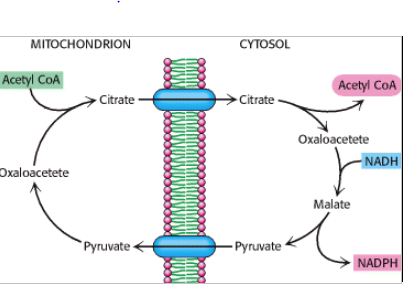
For at transportere acetylCoA fra mitekondriet (hvor det dannes) ud i cytosolen, hvor syntesen foregår, bruges en shuttle.
Her kondenserer acetyl CoA via TCA med OAA og danner citrat, der kan transporteres ud i cytosol. Her agerer citrat lyasen og nedbryder under forbrug af ATP citrat til OAA og acetyl CoA igen, hvilket aktiveres af insulin og herved adskiller denne situation fra en faste situation, hvor højt niveau af acetyl CoA stammer fra øget beta-oxidation. Acetyl CoA omdannes til malonyl CoA, mens OAA omdannes til malat af malat DH under omdannelsen af NADH til NAD+. Malat kan herefter transporteres ind i matrix igen eller omdannes til pyruvat af malic enzym, der omdanner NADP+ til NADPH og samtidigt frigiver CO2. På denne måde omdannes der netto NADH til NADPH.
Samtidigt fungerer citrat også som en allosterisk aktivator af fedtsyre syntese ved at mediere polymerisering af ACC hvilket øger aktiviteten af enzymet gennem en forøgelse af Vmax. Denne polymerisering brydes af phosphoryleringer af fx AMPK som aktiveres af glukagon, adrenalin og lavt energi niveau, hvilket giver mening, idet det er dumt at syntetisere FA hvis kroppen befinder sig en i faste/fight-or-flight situation.
Der skal to NADPH til per acetyl CoA. Derfor skal vi også bruge NADPH fra en anden kilde, nemlig pentose fosfat pathway (PPP).
I hepatocytter, hvor størstedelen af FA syntesen foregår, er den cytosoliske [NADPH]/[NADP+] ratio relativt høj, hvilket giver et godt reducerings miljø (der er energi i at udligne forskellen, altså omdanne NADPH til NADP+). Omvendt gælder det for [NADH]/[NAD+] ratioen, hvorfor NAD+ bruges til oxidering i fx glykolysen.
Palmitat dannes normalt i den overnævnte syntese. I ER og mitochondrierne findes et FA elongerings system, der kan gøre den færdigt syntetiserede FA længere. Her findes også et system, der kan introducere dobbeltbindinger af en desaturase (mixed-function oxidase), under forbrug af NADPH og dannelse af vand. Dette system kan i pattedyr ikke indføre dobbeltbindinger mellem C-10 og methyl-terminal enden, hvorfor FA, der har dobbeltbindinger i dette område og som skal bruges i kroppen, betegnes essentielle (her kan nævnes ω-3/6/9-FA).
Fedtvævs endokrine funktioner
Fedtvæv secenerer forskellige hormoner (adipokiner), heraf:
Leptin: nedsætter sulten via α-MSH (+) og NPY (-) samt sætter forbrændingen op. Gør lever- og muskelceller mere insulin sensitive samt øger insulin sekretion fra pancreas. Secerneres i forhold til mængden af fedtlager og kan derfor anses som negativ feedback. Yderligere stimuleres leptin sekretion af stress hormoner (glucocorticoider og inflammation – som ofte ses ved kraftig overvægt).
Adiponectin: øger optag af FA fra blodet af myocytter samt rate af beta-oxidation. Samtidigt auto-signalerer adiponectin til fedtvævet om at stoppe lipogenese. Secerneres typisk ved vægttab.
Disse er blot nogle få eksempler på hormoner fra fedtvævet, faktisk mener mange at fedtvævets udskillelse af hormoner er kroppens måde at holde ”styr” på energiniveauet i organismen, altså signalering om hvor meget energi der er i depoterne. Disse signaler bruges så til at regulere metabolismen i kroppen. Ved ekstrem fedme eller metaboliske sygdomme så som diabetes sker der dysfunktion i denne cross-talk, hvormed kroppen mister ”overblikket” over hvordan energi situationen egentlig er idet fedtvævet ikke respondere korrekt på stimuli fra fx insulin. Dermed får kroppens andre organer ikke korrekt feedback fra fedtvævet og kan derfor ikke regulere energiniveauet korrekt eftersom fedtvævet er det primære ”buffer”-organ til i denne regulering.
Ved stærk overvægt er der et generelt overskud af energi, der er lagret som fedtvæv. I dette fedtvæv kan der opstå kronisk inflammation. Adipocytter kan undergå apoptose pga. unormale fedt koncentrationer (lipotoksisitet). Der kan opstå en situation, der betegnes metabolisk syndrom hvor der er høj [VLDL] og [LDL], men lav [HDL], øget blodsukker, begyndende insulin resistens, øget blod-lipid niveau, gener forbundet med adipocytter er nedreguleret i fedtvævet, men opreguleret i andet væv (fx lever og muskler). TAG lagres ektopikalt.
Fedtsyremetabolismen ved faste
Hjernen vil via det sympatiske nervesystem signalere til adipocytter ved at sende noradrenalin ud i synapse kløften, der sætter sig i sin receptor på adipocytten, den β-adrenerge receptor. Dette vil aktivere PKA via samme pathway som ovenfor nævnt. PKA vil fosforylere perilipin, der derved give bedre adgang til fedt dråben for HSL (og andre lipaser), der også vil aktiveres af PKA fosforylering og derfor hydrolysere TAG til FA og glycerol. Glycerol vil diffundere til leveren via blodet og indgår via to steps som DHAP i glykolysen/glukoneogenesen, mens FA transporteres vha. serum albumin.
Dette vil give en netto øgning i frigivelsen af FA fra det adipøse væv, hvorfor der generelt er en øget koncentration af FA i blodet. Dette vil automatisk få alt det væv, der kan forbrænde FA til at optage disse.
Leveren vil altså hovedsageligt forbrænde FA, der bliver nedbrudt til acetyl CoA. Disse vil ikke alle kunne blive nedbrudt fuldstændigt i TCA, da komponenter fra TCA (OAA) bruges til at danne glukose i glukoneogenesen, der øges efter et døgns tid da glykogenlagret her er opbrugt. Husk, at F2,6BP øger glykolysen og sænker glukoneogenesen, og [F2,6BP] sænkes af glukagon idet DBE fosforyleres.
Nu har vi en situation i leveren, hvor der er et øget niveau af acetyl CoA, hvilket vil sætte gang i dannelsen af keton stoffer, der bliver sendt ud i blodet. Således vil leveren lukke glukose ud fra glukoneogenesen, glykogen samt lave keton stoffer til de andre væv og selv forbruge FA, så der ikke spildes glukose. Husk, at leveren ikke selv er i stand til at nedbryde KB. Husk yderligere, at KB syntese kun er aktuelt i ekstrem faste >1-2 dage uden mad.
Musklerne vil ligeledes forbruge FA i stedet for glukose, hvilket også reguleres af [FA] i blodet. Mere FA vil komme ind i myocytten og blive nedbrudt først via β-oxidation, dernæst TCA og til sidst elektron transport kæden. [NADH] samt citrat vil stige, hvorfor glykolysen og PDH vil blive hæmmet. [F6P]/[G6P] vil stige, hvilket vil hæmme hexokinasen, der fosforylerer og dermed determinerer glukosen til nedbrydning i cellen. Dette vil derfor ikke ske og glukosen blive i blodet (glukose-FA cyklus).
Det øgede niveau af FA i blodet vil derfor modvirke forbrændingen af glukose og samtidigt via leveren give et alternativt substrat i form af KB.
α2-adrenerge receptorer er vigtige i adipocytter og er linket til et Gi (i for inhibitory) protein, der inaktiverer adenylat cyklasen for at moderere effekten på lipolysen. Dette aktiveres både af adrenalin og noradrenalin fra det sympatiske nervesystem.
Derudover aktiverer FA og KB i blodet insulin sekretion for at afbalancere systemet.
Hvad sker der mere ved faste?
Myocytter vil typisk forbrænde FA samt en smule protein, alt efter hvilket stadie, fasten er i. Reguleringen kaldes glukosefedtsyrecyklus. FA optaget vil automatisk stige som niveauet af FA i blodet stiger. Dette vil hæmme forbruget af glukose idet acetyl CoA niveauet samt [NADH] vil stige og dermed hæmme glykolysen og PDH. Samtidigt vil citrat niveauet stige, hvilket hæmmer PFK-1.
Glykogen lageret i leveren vil holde ca. et døgn. Derefter vil der ikke være mere glykogen, der kan frigive glukose til blodet og TAG-lageret vil derfor bliver tæret på. Derudover vil en smule protein fra musklerne nedbrydes, hvilket vil blive undertrykt, da dette ikke er sundt for kroppen og kun i yderste nødstilfælde vil bruges. Forbruget af protein som energikilde er det, der i sidste ende er fatalt ved fasten, pga. nedbrydning af vitale muskler, som fx hjertet.
I en faste situation vil blodsukker niveauet først falde lidt i forhold til det sidst indtagne måltid, men finde et stabilt leje omkring 4-5mM. Dette vil ske som følge af de ovennævnte regulerings mekanismer. Derimod vil [FA] stige i løbet af en faste situation, og langsomt erstatte glukose som energikilde i de fleste væv (fx muskler og lever). Husk på, at noget af produktet fra lipolysen, glycerol delen, kan indgå i glukoneogenesen. Derudover vil KB være en indirekte vej af FA forbrænding i fx hjernen, der ellers ikke kan optage FA.
Det er vigtigt at holde et konstant niveau af glukose i blodet, da der er flere væv, der er dybt afhængige af denne metabolit som energikilde. Fx er de røde blodlegemer afhængige af glukose, da de ikke har mitochondrier og derfor kun kan udføre det første trin af de tre trin i den fuldstændige oxidation (glykolyse, TCA og elektron transportkæden). Hjernen er også afhængig af glukose, men kan tilpasse sig til at forbruge KB, da hjerneceller har mitochondrier, men blod-hjerne barrieren er for tæt til at FA kan trænge igennem.
Det er yderligere vigtigt for kroppen at KB er absolut sidste udvej idet ketoner er svage syrer og derfor påvirker kroppens syre/base balance, høje koncentrationer kan udkonkurrere kroppens bicarbonate buffer kapacitet hvorved pH pludselig falder kraftigt hvilket er betegnet som acidose, når det er forårsaget af KB kaldes tilstanden ketoacidose, hvilket er livstruende. Dette vil sjældent opstå i raske, fastende individer, da FA og KB stabiliseres ved at de i sig selv øger insulinsekretionen og herved skaber en balance.
Fedtsyntese – opbygning af fedt
Essentielle fedtsyrer
I ER findes der et system til indfører dobbeltbindinger i palmitat. Dette system er imidlertid ikke i stand til at indføre dobbeltbinder efter Δ9 og til methyl enden. Reaktionen katalyseres af fatty acyl-CoA desaturase, der forbruger NADPH og producerer vand. Linoleat: 18:2 (Δ9,12 ) har som angivet i parentesen en dobbeltbinding i position 9 samt 12, hvorfor pattedyr ikke kan danne denne fedtsyre og denne er derfor en essentiel fedtsyre. Når først man har indtaget linoleat kan man ud fra denne danne andre fedt syrer så som arachidonat vha. eleongerings systemet, der også findes i ER samt desaturering i positioner før delta 9. Da dette elongerings system fungerer som FA synthasen sker elongeringen i syre-enden af fedtsyren og nummereringen af eksisterende dobbeltbindinger rykker derfor med to (2 carbon-atomer indføres); fx fra gamma-linolenate (Δ6,9,12) til eicosatrienoate (Δ8,11,14).
Dannelse af phospholipider og triglycerider
Phosphatidat er central intermediat i både TAG syntesen (øges af insulin) og glycerofoforlipider. Dette intermediat kan også betegnes diacylglycerol-3-P og dannes ad to forskellige veje:
- I adipocytter mobiliseres glycerol delen fra DHAP, der jo indgår i glykolysen. Glycerol 3-P DH katalyserer denne reaktion.
- I lever og nyrer eksisterer en glycerol kinase, fosforylerer glycerol til glycerol-3-P under forbrug af ATP.
Ud fra glycerol-3-P dannes så phophatidat ved at tilføje to aktiverede fedtsyrer (FA-CoA). Disse aktiverede FA dannes på samme måde som når fedtsyrerne aktiveres til beta-oxidation (dette foregår i cytosolen) af acyl-CoA synthetasen under forbrug af to ATP. Disse to FA-CoA overføres til glycerol-3-P (én ad gangen) katalyseret af acyl transferasen.
Glycerofosfolipider dannes ud fra phosphatidat ligesom TAG eller ud fra diacylglycerol. Når en hoved-gruppe skal sættes på, skal enten glycerol-delen eller hovedgruppe-delen aktiveres med CDP. Således kan enten CDP-diacylglycerol og hovedgruppe eller diacylglycerol og CDP-hovedgruppe forbindes i en fosfodiester binding under frigivelse af CMP som resultat af et nukleofilt angreb af en hydroxylgruppe.
Dannelse af sphingolipider
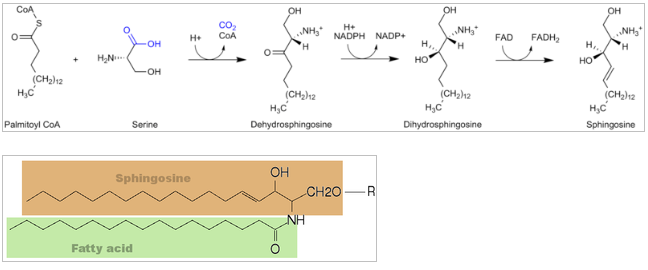
Sphingolipider er en klasse af lipider, der dannes ud fra det alifatiske amino alkohol sphingosin.
Fra palmitoyl CoA og serin dannes sphinganin, hvorpå en FA sættes på via en amid binding og vi får N-acylsphingosin (ceramid) (i ER). Efter påsættelse af en hovedgruppe får man herefter forskellige sphingolipider (alt efter typen af hovedgruppen): cerebrosider eller sphingomyelin (i Golgi).
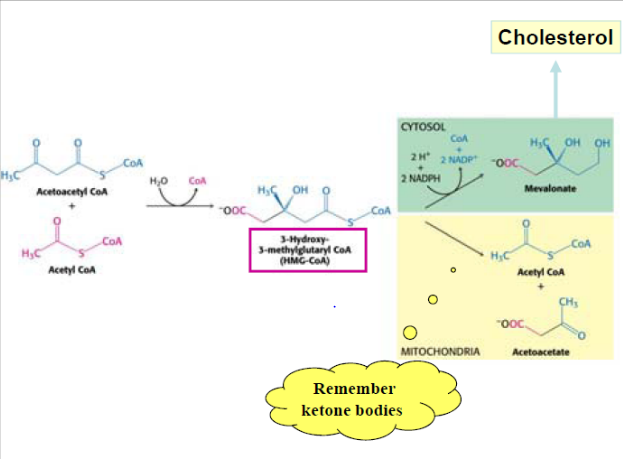
Biosyntese af cholesterol
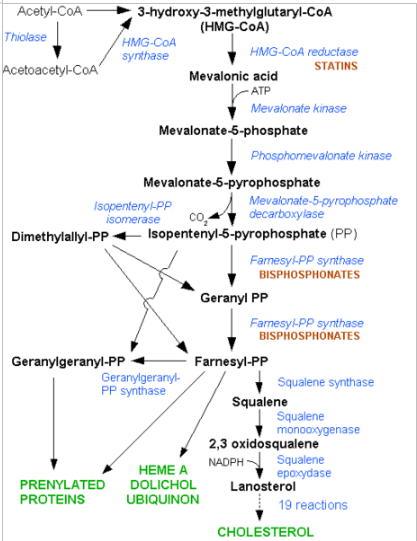
Kolesterol dannes ud fra acetyl CoA. To acetyl CoA molekyler kondenserer til Acetoacetyl CoA, der igen kondenserer med endnu et acetyl CoA molekyle til HMG-CoA. Dette katalyseres af lyasen og HMG-CoA synthasen.
Dette intermediat indgår også i syntesen af keton stoffer, der dannes i leveren i faste situationer eller i ubehandlet diabetes. Vær dog opmærksom på følgende i figuren nedenunder: HMG CoA sythasen eksisterer i to isozymer i hhv. cytosol og det mitochondrielle matrix. Førstnævnte agerer i syntesen af cholesterol, mens sidstnævnte agerer i syntesen af keton stoffer, der foregår i matrix og de to syntese-veje er derfor fuldstændigt adskilte.
Herefter sker der en reducering af HMG CoA til mevalonat katalyseret af HMG CoA reduktasen, der forbruger 2 NADPH og sidder integreret i membranen i smooth ER. Dette er det hastighedsbestemmende step i syntesen af kolesterol.
Herefter skal der forbruges tre ATP for at omdanne mevalonat til aktiverede isopren enheder. Herefter skal seks isopren enheder (i form af isopentenyl pyrofosfat) kondenseres til squalen. Dette molekyle skal nu omdannes fra lineær struktur til ringstrukturer. Først adderer squalen monooxygenase et oxygen atom under dannelse af vand. Herefter agerer cyklaser og der dannes lanosterol, der endelig bliver til kolesterol.
Der går tre acetyl CoA til et molekyle mevalonat. Der bruges seks mevalonat til at danne seks aktiverede isopren enheder (3 ATP for hver). Vi forbruger derfor 18 ATP og 18 acetyl CoA per kolesterol molekyle.
HMG-CoA reduktasen reguleres kovalent igennem fosforylering, idet det aktiveres af insulin og deaktiveres af glukagon.
Derudover kan man ved for højt kolesterol niveau behandles med statiner, der ligner Mevalonate og virker som kompetitive hæmmer af HMG-CoA reduktasen. Kolesterol selv virker også i en feed back hæmning. Transkriptionelt reguleres en række komponenter i forbindelse med kolesterol, heriblandt LDL-receptoren og HMG-CoA reduktasen af et system, der sidder i ER membranen (SCAP-SREBP system).
Dette system består af SREBP, der indeholder et basic helix-loop-helix leucine zipper domæne (bHLH-zip) som kan fungerer som transkriptionsfaktor. Dette domæne kan kløves af SREBP aktivere transkriptionen af ovennævnte gener samt as SCAP, der er en kolesterol sensor og tilbageholdes i ER membranen ved interaktion med kolesterol.
Når [kolesterol] er høj holdes SREBP tilbage af SCAP, der ligeledes sidder i ER membranen og der sker ikke noget.
Når [kolesterol] er lav tilbageholdes komplekset ikke længere, men migrerer til Golgi, hvor SREBP kløves to gange af forskellige proteaser (S1P og S2P), hvilket frigiver det transkriptionelt aktiverende domæne, der translokeres til nukleus, hvor den aktiverer transskriptionen af en række gener involveret i cholesterolsyntese og fedtsyre syntese generelt.
Udover at virke som buffer for fluiditeten i membranerne (virker afstivende) i cellen kan kolesterol omdannes til forskellige vigtige komponenter. Vigtigst af disse komponenter er vitamin D og steroid hormoner, som fx kønshormoner.
I tilfælde af for meget kolesterol kan dette transporteres til leveren via HDL (reverse cholesterol transport), hvor dette kan omdannes til galde salte og herved udskilles i tarmen. Galde salte vil naturligvis også blive dannet, selvom der ikke er for meget kolesterol, da disse er vigtige i opløsningen af fedt i tarmen indtaget via kosten. Galde salte er den eneste måde vi kan komme af med cholesterol på, derfor er det meget vigtigt at kontrollere cholesterol indtag i et sundhedsmæssigt perspektiv da det er meget svært for kroppen af eliminere.
Transport af fedt
Det nydannede fedt transporteres som TAG i VLDL fra leveren til det adipøse væv. Pathwayen betegnes som den endogene, da FA stammer fra syntese i kroppen og ikke udefra. Fra VLDL i blodet skal TAG optages i adipocytterne og TAG skal derfor hydrolyseres til frie FA og glycerol for at kunne kommer over membranen. Derfor er apolipoproteinet CII i VLDL nødvendig for aktivering af lipoprotein lipasen (LPL) i kapillærerne. Husk, at LPL i forbindelse med det adipøse væv også aktiveres af insulin. Således frigives FA, der optages i adipocytterne og afhængig af mængden af DHAP (fra glykolysen), der omdannes til glycerol-3-P, re-esterificeres til TAG og oplagres. Glycerol-delen diffunderer via blodet tilbage til leveren hvor det gennem gluconeogenese laves til glucose som tilgår blodet.
Alle VLDL partikler indeholder apoB100, men først idet VLDL under afgivelse af TAG og andre lipider i vævet omdannes til LDL, aktiveres apoB100, da bindings domænet for LDL-receptoren bliver tilgængelig.
LDL-receptoren binder til apoB100 hvilket aktiverer endocytose, betegnes receptor medieret endocytose. Hele LDL-partiklen indtages altså i cellen modsat tilfældet for HDL-partikler.
Den indre del af plasmamembranen er beklædt med proteiner (clathrin og AP2 complex), der medierer endocytosen.
Endosomet fusionerer herefter med et lysosom, der indeholder enzymer, der kan nedbryde indholdet af lysoendosomet, hvorved FA og cholersterol frigives mens apolipoproteinerne nedbrydes til aminosyrer. Receptoren genbruges og sendes tilbage til plasmamembranen.
Sidst opdateret 31. maj 2023