Mange egenskaber ved molekyler, som f.eks. bindingsvinkler for nogle molekyler, kan ikke forklares ved almindelige atomorbitaler (s-orbitaler, p-orbitaler osv.). Mange egenskaber for molekyler kan bedst forklares ved at konstruere nogle nye orbitaler, kaldet hybridorbitaler, som dannes ved hybridisering af atomorbitaler (hybridisering = sammenblanding). Man danner altså hybridorbitalerne for et molekyle ved at lave en sammenblanding af valensorbitaler.
sp3-hybridiserede orbitaler
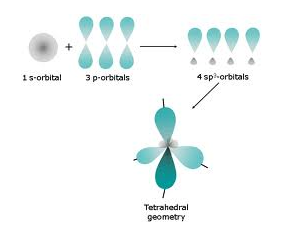
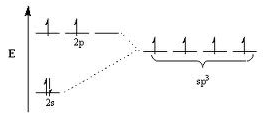
sp3-hybridiserede orbitaler, som f.eks. ses i methan, ethan osv., dannes ved at hybridisere en s-orbital og 3 p-orbitaler, så der dannes 4 nye sp3-hybridiserede orbitaler. Disse har en form der minder lidt om formen af p-orbitaler (der er en dobbeltballon), men blot hvor den ene ballon er lidt formindsket i forhold til den anden. Ofte tegner man kun den store ballon, da den lille ballon er sålille i forhold til den store.
Energien for de 4 nye sp3-hybridiserede orbitaler vil være et sted imellem energien af p-orbitaler og s-orbitaler.
De nye hybridiserede orbitaler arrangerer sig omkring atomet så de kommer længst væk fra hinanden. Således kommer der en vinkel på ca. 109o imellem sig.
En binding mellem enten to sp3-hybridiserede orbitaler eller en hybridiseret orbutal og én s-orbital kaldes for en σ-binding eller en enkeltbinding.
sp2-hybridiserede orbitaler
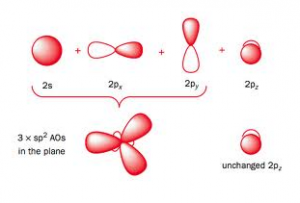
Her sker der en hybridisering af 1 s-orbital og 2 p-orbitaler således at der dannes 3 sp2-hybridiserede orbitaler og 1 p-orbital tilbage. Sp2-hybridiserede orbitaler har samme form som sp3-hybridiserede orbitaler.
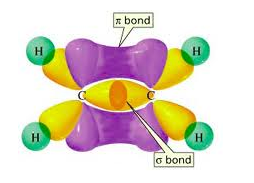
Bindinger mellem de hybridiserede orbitaler kaldes for en σ-binding, mens den binding der er mellem p-orbitalerne kaldes for en π-binding. Således består en dobbeltbinding af 1 σ-binding og 1 π-binding. Π-bindingen er svagest pga. dårligst overlap.
Sp2-hybridiserede orbitaler danner en vinkel på 120o imellem sig.
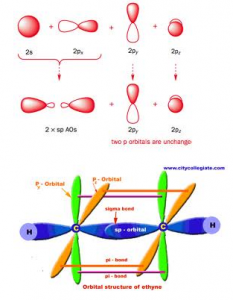
Sp-hybridiserede orbitaler
Sp-hybridiserede orbitaler er en hybridisering mellem en s-orbital og en p-orbital, således at der dannes to sp-hybridiserede orbitaler og 2 p-orbitaler. Bindinger mellem disse kaldes igen for σ-bindinger og bindinger mellem p-orbitalerne kaldes for π-bindinger. En binding bestående af 1 σ-biding og 2 π-bindinger kaldes for en trippelbinding og sp-orbitaler danner en vinkel på 180ograder mellem sig.
Sidst opdateret 30. maj 2023