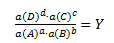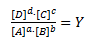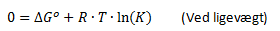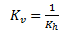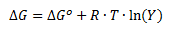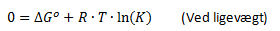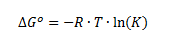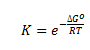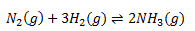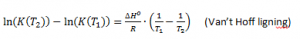I denne artikel gennemgås det generelle ved kemisk ligevægt. Kemisk ligevægt er en tilstand for en kemisk reaktion, hvor reaktionshastigheden mod højre er lig med reaktionshastigheden mod venstre.
Reaktionsbrøken Y (eller Q)
I princippet kan en reaktion aA + bB -> cC + dD både foregå mod højre og mod venstre. Der gælder følgende relation mellem aktiviteterne af henholdsvis produkterne og reaktanterne.
Hvor a(X)x er aktiviteten af et stof X i en støkiometrisk mængde x og Y er reaktionsbrøken (symboliseres også ofte ved et Q). Aktiviteten af et stof er en størrelse som er enhedsløs (Uden enhed) og hvis værdi tilnærmelsesvist er lig med enten 1, koncentrationen eller trykket afhængig af tilstandsform.
a = 1 for faste stoffer
a = 1 for solventer
a = [X] for opløste stoffer (Værdien i M – dog uden enhed)
a = p(X) for gasser (værdien i bar – dog uden enhed)
Dette betyder at man kan tilnærmelsesvist bestemme følgende ligning:
Ligevægtskonstanten K (eller Keq)
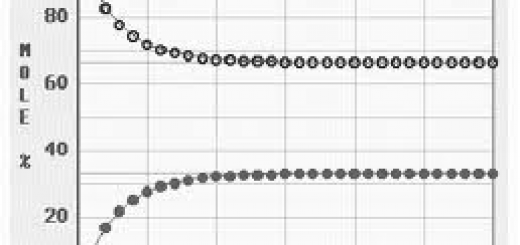
Reaktionsbrøken Y er ikke konstant. I starten af en reaktion hvor man blander reaktanterne sammen og starter reaktionen, vil Y stige. På et tidspunkt har Y nået et konstant niveau og reaktionshastigheden mod højre er lig med reaktionshastigheden mod venstre. Det betyder ikke at reaktionen ikke længere foregår – det betyder blot at for hver gang 1 molekyle A og 1 molekyle B går sammen og reagerer til 1 molekyle C og 1 molekyle D, vil der også være 1 molekyle C og 1 molekyle D der går sammen og bliver til 1 molekyle A og 1 molekyle B. Når denne tilstand er nået siges reaktionen at være i ligevægt og der vil gælde at Y = K og dermed:
Koncentrationerne af reaktanterne vil ved reaktionens start og frem mod ligevægt falde mod en asymptote (vandret ret linje). Omvendt vil produkterne ved reaktionens start og frem mod ligevægt stige mod en asymptote.
Sammenlægning af reaktioner (ligesom ved Hess’lov)
Vi så tidligere at man ved at lægge to reaktioner kunne lægge enthalpiændringer sammen. Men ved ligevægtskonstanter skal de ganges sammen.
C (s) + ½ O2 (g) -> CO(g) K(A)
CO (g) + ½ O2 (g) -> CO2 (g) K(B)
C (s) + O2 (g) -> CO2 (g) K(C) = K(A)·K(B)
Størrelsen af ligevægtskonstanten
Hvis ligevægtskonstanten er større end reaktionsbrøken, går reaktionen netto mod højre. Hvis ligevægtskonstanten er mindre end reaktionsbrøken, går reaktionen netto mod venstre. Hvis ligevægtskonstanten er lig med reaktionsbrøken er der ligevægt.
K>Y Reaktionen går netto mod højre
K=Y Reaktionen er i ligevægt
K<Y Reaktionen går netto mod venstre
Ligevægtskonstanten vil altid være positiv, da koncentrationer kun er positive. Hvis ligevægtskonstanten er et meget stort tal, betyder dette at reaktionen stort set foregår fuldstændigt mod højre. Hvis ligevægtskonstanten er et meget lille tal, betyder dette at reaktionen stort set ikke foregår mod højre.
K meget stor Reaktionen foregår fuldstændigt mod højre
K omkring lig 1 Mængden af reaktanter og produkter ved ligevægt er lige store
K meget lille Reaktionen foregår stort set ikke mod højre
Hvis K er meget stor og dermed foregår fuldstændigt, kan man skrive en enkelt reaktionspil mod højre, for at markere at den stort set ikke foregår mod venstre. Dette ses f.eks. ved reaktionen af en stærk syre (HCl) med vand:
HCl + H2O -> Cl– + H3O+
Man kan, hvis man kender ligevægtskonstanten for reaktionen mod højre Kh beregne ligevægtskonstanten for reaktionen mod venstre Kv ved at tage den reciprokke værdi.
Gibbs fri energi og ligevægt
Der gælder følgende sammenhæng mellem ΔG og ligevægtsbrøken Y.
Hvor ΔG er gibbs fri energi ændring, ΔGo er standardændringen af Gibbs fri energi, R er gaskonstanten (8,31 J/(mol·K)), T er temperaturen i K og Y er reaktionsbrøken.
Som tidligere nævnt under afsnittet med Gibbs fri energi, så er der ligevægt når ΔG = 0. At ΔG = 0 betyder ikke at ΔG° = 0. Men dette betyder at der ved ligevægt gælder følgende sammenhæng:
Dette kan også omskrives til:
Med denne formel kan man altså beregne standardændringen i Gibbs fri energi hvis man kender ligevægtskonstanten. Vil man beregne ligevægtskonstanten ud fra standardændringen i Gibbs fri energi, kan man omskrive denne formel til:
Udfra denne sammenhæng kan man udlede at hvis standardændringen i Gibbs fri energi er negativ (og dermed en spontan reaktion), så vil ligevægtskonstanten blive større – omvendt vil ligevægtskonstanten falde jo mere positiv standardændringen i Gibbs fri energi bliver. Dog kan ligevægtskonstanten ikke blive negativ.
Indgriben i et ligevægtssystem (Le Chateliers princip)
Le Chateliers princip siger følgende:
Hvis man foretager et indgreb i et ligevægtssystem, så vil systemet reagere i den retning (højre eller venstre) som formindsker indgrebets effekt.
Dette betyder følgende:
Ændring af koncentrationer
Hæver du koncentrationen af reaktanter, vil reaktionen gå mod højre, for at formindske koncentrationen af reaktanten. Hæver du koncentrationen af produkter, vil reaktionen gå mod venstre, for at formindske koncentrationen af produkterne.
Ændring af tryk eller volumen
Hæver du trykket, vil reaktionen gå i den retning der formindsker trykket. Det betyder at reaktionen vil gå i den retning hvor det totale støkiometriske antal formindskes. F.eks. for reaktionen:
Er der totalt 4 molekyler på venstresiden og 2 molekyler på højresiden. For at formindske trykket skal reaktionen gå mod højre, da 4 molekyler så vil omdannes til 2 molekyler. Omvendt kan man hæve trykket ved at reaktionen går mod venstre. Ved at hæve trykket, vil resultatet altså være en forskydning af ligevægten mod højre.
Ændres volumen, således at volumen falder er det det samme som at trykket stiger og således vil reaktionen gå fra venstre mod højre. Hvis volumen stiger, er det det samme som at trykket falder og reaktionen vil da gå mod venstre.
NB: Tilførelse af en inert gas (ædelgas) ændres der ikke på ligevægtsstillingen.
Ændring af temperatur
Hæves temperaturen vil reaktionen gå i den retning der sænker temperaturen, dvs. i den endoterme retning. Omvendt vil en sænkning af temperaturen føre til at reaktionen går i den retning hvor temperaturen stiger, dvs. den exoterme retning.
Van’t hoffs ligning
Van’t Hoff ligningen sammenholder ligevægtskonstanten med temperaturen:
Hvis man ændrer temperaturen fra T1 -> T2 ændrer K(T1) -> K(T2).
Ligevægte og katalysatorer (eller enzymer)
En katalysator ændrer på hastigheden af en reaktion, men påvirker overhovedet ikke en ligevægt. En katalysator fungerer altid som katalysator både for reaktionen mod venstre som reaktionen mod højre.
Sidst opdateret 30. maj 2023