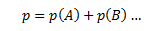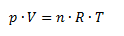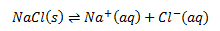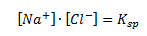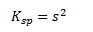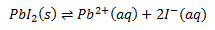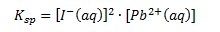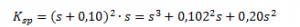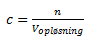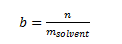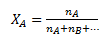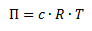En opløsning er en homogen blanding af to eller flere rene stoffer (NB: en homogen blanding er en ensartet blanding, dvs. hvor sammensætningen af blandingen er nøjagtig ens over hele opløsningen). Man skelner mellem det stof der opløses (solut) og det stoffet opløses i (solvent/opløsningsmiddel). En solut siges at være opløselig i solventet, netop hvis det er muligt at opløse det fuldstændigt i solventet ved den pågældende temperatur.
Opløselighed
Opløseligheden defineres som den maksimale mængde af stof der kan opløses fuldstændigt i solventet ved den pågælendende temperatur.
Mættet opløsning
En mættet opløsning er en opløsning hvor man har udnyttet den maksimale opløselighed i opløsningen af et stof. Dvs. at det ikke længere er muligt at opløse mere stof i solventet ved den pågældende temperatur.
Henrys lov
Normale opløsninger er ofte et fast stof der opløses i et flydende solvent. Men der kan sagtens være en opløsning af en gas i et flydende solvent, f.eks. vand. Henrys lov kan anvendes til denne type opløsninger.
Henrys lov siger at der for gasser, som ikke selv reagerer med solventet, vil være en sammenhæng mellem koncentrationen af gassen der er opløst og partialtrykket af gassen og at denne sammenhæng vil være konstant.
KH kaldes for Henrys lov konstanten og denne er unik for hver gasart. cgas er koncentrationen af gasarten der er opløst. pgas er partialtrykket af gaskomponenten som ikke er opløst.
Daltons lov
Daltons lov siger at summen af partialtrykket for hver komponent i en gasblanding altid vil være lig med totaltrykket i gasblandingen.
Hvor p er totaltrykket, p(X) er partialtrykket af komponenten X.
Idealgasloven
Idealgasloven er en af de vigtigste gaslove og sammenholder stofmængden n, tenperaturen T, volumen V og trykket p i en ligning:
Hvor:
p er trykket (i bar, Pa, mmHg…)
V er volumen (i m3, mL…)
n er stofmængden (i mol)
T er temperaturen (i K)
Og R er gaskonstanten. Her vælger man gaskonstant alt efter hvilke andre enheder de andre størrelser har.
Blanding af 2 solventer
To solventer kan enten være blandbare eller ikkeblandbare. For at to væsker er blandbare kræver det at den energi det kræver at fjerne de intermolekylære bindinger fra begge solventer alene opvejes af den energi der kommer fra de intermolekylære bindinger ved blanding af de to solventer opvejer hinanden. Hvis to solventer er blandbare danner de en homogen blanding – ellers dannes der flere lag.
Opløsning af fast stof i et solvent
Hvis et fast stof skal kunne opløses i et solvent, skal først de intermolekylære bindinger i solventet brydes (koster energi), gitteret i det faste stof skal brydes (koster energi) og der skal dannes nye intermolekylære bindinger (giver energi). Den energi det koster skal opveje den energi der gives for at det faste stof er opløseligt i solventet.
Hvis et fast stof let opløses i et solvent kaldes det letopløseligt, opløses det ikke særlig let er det tungtopløseligt og kan det ikke opløses er det uopløseligt.
Opløselighedskonstanten
Hvis man opløser et stof, f.eks. NaCl, i et solvent sker der følgende:
Ligevægtskonstanten vil her være lig med:
Bemærk at man i dette tilfælde kalder ligevægtskonstanten for Ksp eller Kop (sp=solubility product) og konstanten kaldes for opløselighedskonstanten. Bemærk også at man ikke har reaktanten med i ligevægtsloven – dette skyldes selvfølgelig at det er et fast stof og denne indgår i ligevægtsloven med et 1-tal.
Da der ofte ikke er noget produkt når man starter med at opløse et salt, vil produkternes koncentration være lige store og man kan da erstatte hver koncentration i ligevægtsloven med et s. Her vil man kalde s for den molare opløselighed.
Den molare opløselighed er antal mol stof der er opløst i 1 L af den mættede opløsning.
Ioneffekten
Nogle gange opløser man et stof i et solvent der i forvejen indeholder det stof der opløses. Når man gør dette vil saltet altid være mindre opløseligt i et solvent indeholdende en af ionkomponenterne, end hvis man opløste saltet direkte i solventet uden ionkomponenter. Dette kaldes for ioneffekten.
Hvis man f.eks. vælger at opløse PbI2 i en 0,10 M NaI-opløsning. Da NaI dissocierer fuldstændigt, vil start-I-koncentrationen i denne opløsning være 0,10 M. Der sker følgende reaktion:
Ligevægtsloven opskrives nu som:
Normalt ville man nu have erstattet hver koncentration med et s, så man fik at Ksp=s3. Men nu hvor der er I-ioner til at starte med, skal man i stedet skrive:
Kolligative egenskaber
Kolligative egenskaber for en opløsning er egenskaber såsom frysepunktssænkning, kogepunktshævning, osmotisk tryk – som kun afhænger af antallet af partikler fra solutten i opløsningen.
Molaritet c
Molariteten er en koncentration hvor enheden er mol/L eller M og dette er den koncentration som de fleste taler om når man taler om koncentration. Den er altså defineret som:
Hvor:
c er den molare koncentration
n er stofmængden i mol
Vopløsning er volumen af opløsningsmidlet i L
Den molare koncentration ændrer sig med temperaturen, da volumen er temperaturafhængig og derfor er den molare koncentration også temperaturafhængig.
Molalitet b
Molaliteten er en koncentration hvor enheden er mol/kg og dette er en anden type koncentration der ofte benyttes. Denne er definere som:
Hvor:
b er den molale koncentration i mol/kg.
n er stofmængden i mol
msolvent er massen af solventet i kg
Den molale koncentration er i modsætning til molariteten temperaturuafhængig.
Jo mere man opløser et stof i et solvent, desto mere vil molaliteten nærme sig numerisk molariteten.
Molbrøken XA
Molbrøken defineres som stofmængden af et stof divideret med den totale stofmængde af alle stoffer i en opløsning. Denne størrelse er enhedsløs:
Hvor XA kaldes molbrøken for A og nA er stofmængden af A.
Raoults lov
Raoults lov beskriver smmenhængen mellem damptrykket for opløsningen popl, molbrøken for solventet Xsolv og damptrykket for det rene solvent psolv*.
popl = Xsolv·psolv (Fortyndet opløsning)
Kogepunktet
Man definerer altid kogepunktetsom værende den temperatur hvor damptrykket af solventet er lig med det atmosfæriske tryk. Damptrykket af solventet er afhængig af temperaturen og stiger med temperaturen. Det er derfor at når man hæver temperaturen af vand, vil vanddamptrykket (mættet vanddamps tryk) stige indtil det når det atmosfæriske tryk ved 100oC og det er her kogepunktet defineres.
Kogepunktshævelse
Kogepunktshævelsen af en opløsning beskrives ved sammenhængen:
ΔTb = Kb·b
Hvor:
ΔTb er kogepunktshævelsen
Kb er den molale kogepunktshævelseskonstant
b er den molale koncentration
Frysepunktssænkning
Frysepunktssænkning af en opløsning beskrives ved sammenhængen:
ΔTf = Kf·b
Hvor:
ΔTf er frysepunktssænkningen
Kf er den molale frysepunktssænkningskonstant
b er den molale koncentration
Osmose og osmotisk tryk
En membran som tillader at nogle stoffer passerer, men andre ikke gør kaldes forsemipermeabel og man siger at membranen er permeabel over for nogle stoffer og impermeabelover for andre stoffer.
Hvis man har en membran der kun er permeabel overfor et solvent, f.eks. vand, kaldes det en osmotisk membran. Her vil der kunne ske passage af solvent fra lav koncentration af opløste stoffer til en høj koncentration af opløste stoffer (svarer til en høj koncentration af solvent til lav koncentration af solventet). Hvis man skulle forhindre et sådant osmotisk flow af solvent, skal man tilføre et modsat rettet tryk som lige netop kan opveje den osmotiske vandring af solvent. Trykket kaldes da et osmotisk tryk. Der gælder nu en sammenhæng mellem det osmotiske tryk og koncentrationen af opløste stoffer:
(Van’t Hoffs ligning for osmotisk tryk)
Hvor:
Π er det osmotiske tryk
c er koncentrationen af opløste stoffer
R er gaskonstanten
T er temperaturen i K
Bemærk at denne er analog til idealgasloven.
Tonicitet
Celler har både væske uden for cellen og inden for cellen og de to kompartments af væske er adskilt af en membran. Her kan man ændre cellens volumen af væske, ved at ændre på koncentrationen af salte i væsken cellen ligger i.
Man siger at væsken er isotonisk hvis koncentrationen af opløste stoffer er nøjagtig så cellen ikke ændrer volumen (et eksempel på en isotonisk væske er saltvandsopløsning til øjnene og det er her nødvendigt at den er isotonisk for at cellen ikke svulmer op). Man siger at væsken erhypertonisk hvis koncentrationen af salte uden for cellen er større end koncentrationen af salte inden for cellen – i såfald vil cellen formindske sit volumen. En hypotonisk væske er en væske hvor koncentrationen er mindre end inde i cellen og således vil cellen svulme op.
Sidst opdateret 30. maj 2023