Her gennemgår jeg formlen for en svag syres reaktion med vand og beviser den.
Først vil jeg lige definere et generelt ligevægtssystem for en syre der reagerer med vand.
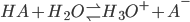
Her er HA en generel formel for en syre (H symboliserer at enhver syre kan afgive en proton) og A- er den deprotonerede, korresponderende base.
Dette er jo en kemisk ligevægt og derfor kan vi opskrive ligevægtsloven for denne:
![K_a = frac{[A^-] cdot [H_3O^+]}{[HA]}](http://medicin.wiki/wp-content/uploads/2014/09/tex_9ad0ef7c8c17b754cc5b354c26e5241c.png)
Bemærk her at vand ikke deltager i ligevægtsloven, da det er solvent og derfor indgår i ligevægtsloven med 1. K_a er syrestyrkekonstanten.
Hvis der ikke var noget korresponderende base til at starte med, så vil den dannede konc. af den korresponderende base stemme overens med koncentrationen af H3O+. Dvs. vi sætter [A-] = [H3O+].
![K_a = frac{ [H_3O^+]^2}{[HA]}](http://medicin.wiki/wp-content/uploads/2014/09/tex_d0182215efd55f6d03324d986f9d8aad.png)
Herudover må [HA] (den aktuelle konc. af syren) jo være lig med den konc. der var til at starte med (kaldet c = den formelle konc. af syren) fratrukket konc. af H3O+ – fordi for hver gang der dannes en H3O+ forsvinder der en syre.
![K_a = frac{ [H_3O^+]^2}{c-[H_3O^+]}](http://medicin.wiki/wp-content/uploads/2014/09/tex_eaea5dd619e489160ef986ac303db4f8.png)
Og her snyder vi en smule. Fordi hvis der er tale om en svag syre er ligevægten forskudt meget mod venstre og derfor vil [H3O+] være meget mindre end c. Derfor kan vi i nævneren (ikke i tælleren) sætte [H3O+] = 0.
![K_a = frac{ [H_3O^+]^2}{c}](http://medicin.wiki/wp-content/uploads/2014/09/tex_fdb7e1696356b5cefeadb9d1dc803d57.png)
Vi tager nu -log på begge sider. Her udnytter vi at -log(pKa) = pKa og at -log[H3O+]=pH.
![pK_a = -log(K_a) = -log frac{ [H_3O^+]^2}{c}](http://medicin.wiki/wp-content/uploads/2014/09/tex_c39ad95d91d164e558205b47d2d3d95e.png)
logaritmen af en brøk er lig med logaritmen af tæller minus logaritmen af nævner.
![pK_a = �-log ([H_3O^+]^2) + log(c)](http://medicin.wiki/wp-content/uploads/2014/09/tex_c8870f8803cc9a3f322a1322ec4dbc59.png)
Logaritmen til en potens er lig med eksponenten gange med logaritmen til roden.
![pK_a = �-2 cdot log[H_3O^+] + log(c)](http://medicin.wiki/wp-content/uploads/2014/09/tex_556b814a126c11a036e4160a3395c130.png)
Vi kan nu trække log(c) fra på begge sider og dividere med 2.
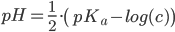
Som er formlen for en svag syres reaktion med vand. Denne gælder altså kun for svage syrer, da vi jo snød lidt længere oppe og sagde at [H3O+] var ca. lig med 0 – hvilket jo bestemt ikke er tilfældet for stærkere syrer.
Sidst opdateret 30. maj 2023
