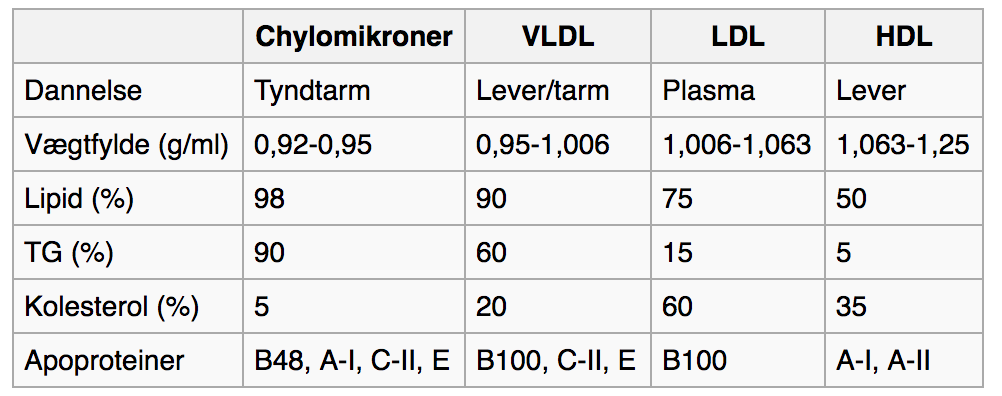
Lipoproteiner er partikler bestående af lipider og proteiner, der transporterer lipider rundt i blodet. Har på overfladen apoproteiner, som aktiverer receptorer, f.eks. i forbindelse med at lipider skal afgives.
Der findes forskellige typer af lipoproteiner, heraf:
- Chylomikroner som transporterer exogent TAG fra tarmene til leveren og andre væv.
- VLDL som transporterer endogent TAG til fedtvæv.
- IDL som også transporterer endogent TAG til fedtvæv.
- LDL som transporterer cholesterol til perifære væv.
- HDL som transporterer rester af lipoproteiner til leveren.
Den endogene pathway for lipoprotein metabolisme
Denne pathway dækker over fordeling af TAG fra leveren til vævet via VLDL, hvilket også er grunden til, at denne pathway kaldes endogen, da TAG er esterificeret fra FA i leveren og ikke tarmen.
Når sekreteret fra leveren indeholder de TAG og CE, ApoB100 og lidt ApoE og –C. Overfladen er lavet af PL og UE kolesterol. Partiklen modtager mere ApoC og –E i plasma fra HDL.
Lipoprotein lipasen (LPL, bliver aktiveret af CII) hydrolyserer TAG til glycerol og FA ude i vævet hvoraf glycerol kommer via blodet til leveren, mens FA optages i vævet og re-esterificeres. Dette kan ske over flere cykler, hvor VLDL partiklen passerer igennem vævet. Overflade komponenter fra den indskrumpende partikel modtages af HDL der på denne måde samtidigt modnes. De udtømte partikler er relativt cholesterol-rige og kan optages via receptorer, der binder ApoB100 og ApoE (LDL receptor hvis udtryk er reguleret af SCAP-SCREBP2 systemet og derfor kun udtrykkes i celler, der mangler kolesterol) og herved afleverer kolesterol til vævet, eller de bliver i cirkulationen og fungerer som kolesterol bærer (LDL). Disse partikler har ApoB100 og PL + fri kolesterol i overfladen og er beriget i kernen af CE.
LDL forlader cirkulation gennem optag i væv af LDL receptoren og afleverer således cholesterol til vævet. De kan have forskellig størrelse og regulerer levering af cholesterol til cellerne. Disse mindre partikler indeholder stadig lidt TAG, der kan blive hydrolyseret af den hepatiske lipase.
Den exogene pathway for chylomicroner
Denne pathway beskriver fordelingen af fedt fra kosten, hvorfor den kaldes exogen. TAG pakkes i chylomicroner i enterocytterne og udskilles først til lymfesystemet hvorfra det via lymfeknuderne træder ind i blodcirkulationen. Ny udskilte partikler har en kerne af CE og TAG og overflade af UE kolesterol, ApoB48 (husk igen, kun eet apoB per partikel)+AI og PL). Hurtigt får chylomicronerene CII fra andre partikler (HDL), så de kan aktivere LPL.
Chylomicronerne transporterer via blodet TAG optaget fra kosten ud til vævet, hvor lipoprotein lipasen (der sidder uden for cellen) hydrolyserer TAG til FA og glycerol som beskrevet ovenfor, hvoraf FA optages i det adipøse væv. Herved bliver partiklen mindre og afgiver samtidigt overflade UE kolesterol og PL og apolipoproteiner til HDL og andre partikler. Herved vil CII også overføres tilbage til HDL.
Resterne af de udtømte chylomicroner optages i leveren, idet apolipoproteinerne på overfladen får en anden konformation og derved bliver ligander for receptorerne, LRP (LDL- receptor related protein).
Reverse cholesterol transport
HDL fjerner kolesterol i overskud fra kroppen og transporterer dette til leveren, hvor det kan bliver udskilt. Derfor kaldes dette for omvendt cholesterol transport i forhold til LDL. Leveren er det eneste sted, hvor man kan komme af med overskydende cholesterol der her kan omdannes til galde salte.
Overførsel af cholesterol til leveren kan ske direkte ved interaktion med specifik SR-BI receptor eller indirekte ved overførsel af CE til TAG-rige partikler, der optages i leveren. Ved receptor-overførsel docker HDL til SR-BI og off-loader CE.
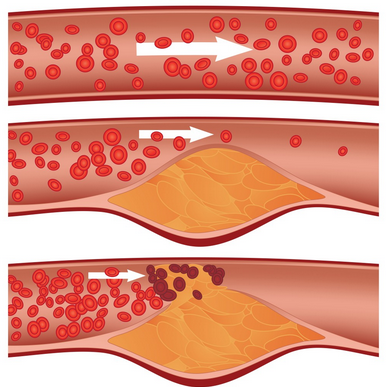
Makrofager har en receptor, der ikke er selvreguleret og optager derfor LDL, og derved cholesterol uhæmmet (scavenger receptoren). Derfor fyldes makrofagerne med cholesterol og bliver til foam cells. Makrofager har især affinitet for kemisk modificerede LDL partikler, fx oxidativt ødelagte, hvilket kan ske i sub-endothele rum. Derfor er små partikler farligst, da disse lettere kan blive presset derud. Makrofagerne i arterievæggen ophobes og atherosclerose kan forekomme.
CETP (cholesterol ester transfer protein) cirkulerer i plasma og katalyserer overførslen af CE og TAG mellem lipoproteiner ved faciliceret diffusion – derfor afhængig af gradient og antal partikler i cirkulation.
Når plasma koncentrationen af TAG er høj (mange VLDL) katalyserer CETP bevægelsen af CE fra HDL til VLDL og TAG fra VLDL til HDL. Herved bliver HDL beriget med TAG og afgiver samtidigt CE til VLDL, der ved afgivelse af TAG bliver til LDL. Det vil altså sige, at forholdet er inverst. Jo højere TAG niveau, desto lavere HDL-cholesterol koncentration.
Cholesterol forbliver i de TAG-rige partikler indtil de er taget op i leveren eller optages af makrofagerne, hvilket som ovenfor beskrevet kan medføre atherosclerose. TAG i HDL hydrolyseres af den hepatiske lipase.
Primær og sekundær hyperlipidæmi/hyperlipoproteinæmi
Hyperlipidæmi er for meget fedt i blodet og hyperlipoproteinæmi er for meget lipoprotein i blodet. Det måles ved cholesteroltallene i en blodprøve. Det inddeles i primær og sekundær. Primær er genetisk bestemt, mens sekundær er afhængig af livsstil.
Eksempler på primær:
- En fejl i LDL receptor medfører at LDL partikler forbliver i cirkulation og cholesterol syntese er ikke nedreguleret (akkumulering af cholesterol).
- Variation i ApoE gen (ApoE4 dårlig) medfører at remnant ikke kan binde til LDL receptor hvilket betyder akkumulering af chylomikrone- og VLDL remnants.
- Hyperlipoproteinenia er øget niveau af chylomicroner i blodet og defekten ligger ofte i LPL eller mangel på CII, hvilket fører til akkumulering af chylomikroner (TAG), da TAG ikke kan hydrolyseres og FA dermed ikke optages i vævet.
Eksempler på sekundær:
- Højt niveau af TAG fra kost. Mættede FA hæmmer UE cholesterol, hvorfor udtrykket af LDL receptoren hæmmes hvilket betyder at plasma LDL øges.
Hypercholesterolæmi
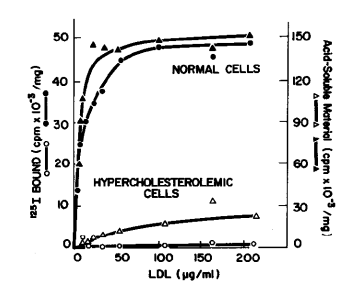
Patienter med hypercholesterolæmi har et højere niveau af kolesterol i plasma end normale mennesker. Fibroblaster isoleret fra hyperkolesterolæmi patienter har en mindre kapacitet til at binde og nedbryde LDL end celler fra sunde mennesker. Nedenstående graf viser binding til (cirkler) og nedbrydning (trekanter) af radioaktive, 125-I-mærkede LDL partikler i fibroblastceller fra sunde mennesker (normal cells, ●, ▲) og fra patienter med hypercholesterolæmi (hypercholesterolemic cells, ○, ).
Vi ser at binding af LDL til normale fibroblastceller er maximalt med ca. 0.05 cpm/mg bundet radioaktiv LDL med 100 til 150 µg/ml LDL i mediet. Derimod er binding af LDL stærkt reduceret (ca. 10 gange) i cellerne fra hyperkolesterolæmipatienter med bare 0.005 cpm/mg bundet radioaktiv LDL med 100 til 150 µg/ml LDL i mediet. Denne effekt påvirker også nedbrydning af LDL partikler udtrykt som radioaktivitet opløselig i syre (acid-soluble material): Nedbrydning af LDL er næsten fuldstændig blokeret i cellerne fra hyperkolesterolæmipatienter.
LDL binder via apolipoprotein B100 specifikt til LDL receptoren på celleoverfladen (faktisk kan man konkludere, at der er en LDL receptor idet bindingen mættes). Komplekset mellem LDL og LDL receptoren bliver internaliseret ved hjælp af endocytose. Ved denne proces dannes endocytotiske vesikler som inholder LDL og LDL receptor. Vesiklerne fusionerer derefter med såkaldt tidlige endosomer (early endosomes). I dette kompartment er pH værdien reduceret, som bevirker at LDL dissocierer fra receptoren. Receptorerne recirkuleres via vesikler til plasmamembranen og kan binde og optage nye LDL partikler, mens LDL transporteres til sene endosomer og lysosomer. I disse ”compartments” er der en endnu lavere pH værdi som gør at LDL nedbrydes; kolesterolestere hydrolyseres og kolesterol frigives. I patienter med hyperkolesterolæmi er LDL receptoren muteret således at LDL kan ikke binde og dermed ikke blive optaget i cellerne. Følgelig bliver LDL ikke transporteret til lysosomer og kan ikke blive nedbrudt.
Sidst opdateret 31. maj 2023